作为抗衰领域的前沿成分,尿石素 A(UrolithinA)这一天然多酚代谢产物,凭借其独特的细胞代谢调控机制,近年成为科学界与产业界的关注焦点。
邦尚健康作为尿石素A原料生产商,始终以医药级标准生产高纯度原料,并秉持 “科学先行”的研发理念持续投入临床探索与验证。继2025年上半年完成首项口服美容临床实验后,第二项关于尿石素A改善睡眠质量的临床研究也已通过伦理审查并进入实施阶段。这项针对中老年人睡眠健康的随机平行四盲对照实验,不仅聚焦碎片化睡眠、昼夜节律失调等现代健康问题,更旨在通过多维度生物标志物监测,系统性验证尿石素A在睡眠和抗衰领域的全谱价值。
一、睡眠危机:现代生活方式下的“衰老加速器”
数据显示,全球30%-35%的成年人受困于睡眠障碍1。在数字化浪潮中,熬夜工作、碎片化娱乐、昼夜颠倒等生活方式已成为常态,由此引发的睡眠不足问题正成为从细胞、器官到系统层面加速人体衰老进程的“隐形杀手”。
1.碎片化睡眠:从“睡眠剥夺”到“细胞损伤”的级联反应
碎片化睡眠是一种常见的睡眠障碍,指在睡眠过程中由于外源和内源性因素导致的睡眠中断和觉醒,睡眠不深且不连贯2。研究显示,约65.91%的被调查者有此类睡眠困扰,其中,35-44岁年龄段的睡眠困扰率最高,达71.95%3,其危害远超单纯的疲劳感:
细胞代谢紊乱:睡眠中断会破坏肌细胞蛋白合成,增加心肌中的脂肪酸氧化和自由基ROS,同时在肝细胞中引发氧化应激,导致肝脏损伤4;
衰老细胞蓄积:慢性睡眠不足使细胞衰老标志物p16INK4a的表达在小鼠主动脉壁中显著增加,且细胞促炎因子IL-6增加约1倍,加速炎症和组织退化5;
代谢综合征风险:碎片化睡眠会增加机体胰岛素抵抗的发生率和血糖水平,与内脏脂肪堆积形成恶性循环4。
2.昼夜节律失调:当“生物钟”遭遇“光污染”
现代社会的光照环境(如蓝光暴露)与不规律作息,正系统性破坏人体昼夜节律。作为调控睡眠-觉醒周期的核心机制,昼夜节律通过视交叉上核(SCN)协调全身基因表达的24小时振荡6。研究表明,昼夜节律失调对健康的影响深刻而广泛:
时钟基因异常:夜班工作者的时钟基因PER1和BMAL1节律普遍延迟2.5-3小时,进一步影响褪黑素分泌节律7;
炎症失控:节律紊乱使Th17细胞活化增强,IL-17A水平升高,与银屑病、类风湿关节炎等炎症性问题密切相关8(Th17细胞是一类促炎型T细胞亚群,IL-17A是其分泌的核心细胞因子,两者是机体炎症反应和自身免疫性疾病的关键驱动因素)。
NAD+代谢失衡:NAD+(烟酰胺腺嘌呤二核苷酸)是维持细胞代谢和能量稳态的重要辅酶,而SIRT1蛋白是NAD⁺代谢的重要调控因子,其昼夜节律性波动受时钟基因调控。当生物节律紊乱时,NAD⁺峰值浓度会显著下降,大大削弱细胞能量稳态的维持能力9。
3.更年期睡眠障碍:雌激素撤退引发的“多重打击”
女性睡眠困难通常始于绝经过渡期,绝经后患病率增加,自我报告的睡眠问题发生率为40%-56%10,其主要病理机制涉及:
雌激素受体重塑:雌激素撤退导致大脑视前区GAT-1GABA转运蛋白基因的转录降低,从而减少细胞外GABA浓度,增加夜间觉醒风险11。
血管舒缩症状:约85%的更年期女性有潮热症状,潮热发作时,核心体温会发生急速小范围波动,从而影响睡眠周期12。
4.情绪-睡眠负反馈循环:焦虑抑郁与睡眠障碍“如影随形”
现焦虑和抑郁患者常面临严重的睡眠问题,而长期睡眠障碍也会进一步增加焦虑和抑郁风险,与白班工人相比,夜班工人患抑郁症的可能性要高40%13,二者相互影响的核心机制包括:
皮质醇节律异常:抑郁会导致激素节律,例如褪黑激素和皮质醇节律的振幅降低,影响大脑中基因表达的昼夜节律模式,从而导致睡眠障碍13。
血清素功能失调:血清素受昼夜节律控制,长期睡眠障碍易使血清素(5-HT)神经递质功能失调,导致抑郁焦虑等不良情绪发生或加剧14。
二、尿石素A的“睡眠-抗衰-美肤”三重调控:白天有精力,夜晚睡得香,肌肤焕活力
1.双轴调节昼夜节律,从肠道到全身的时钟同步
尿石素A的独特优势在于其对肠道-全身节律轴的双向调控:
肠道屏障节律修复:昼夜节律对维持肠道稳态及免疫功能起决定性作用。尿石素A可通过调控肠道上皮细胞中核心时钟基因的表达节律,逆转炎症诱导的时钟基因与紧密连接蛋白节律紊乱。在动物模型中,尿石素A不仅恢复了小鼠结肠组织中紧密连接蛋白(Clnd1、Clnd4)和时钟基因(BMAL1、PER2)的正常表达节律,还有效调节下丘脑视交叉上核(SCN)的中枢时钟系统15。
衰老细胞节律重编程:昼夜节律时钟精准调控生物体的多项生理活动,而衰老进程会削弱其时间精度与稳健性,表现为基因振荡的节律延长、振幅衰减。在衰老及增殖状态的TIG-3细胞模型中,尿石素A可显著增强BMAL1启动子驱动的荧光素酶振荡振幅,衰老细胞的振幅提升达约4倍,且呈剂量依赖性16,提示其对衰老细胞的节律功能具有深度修复作用。
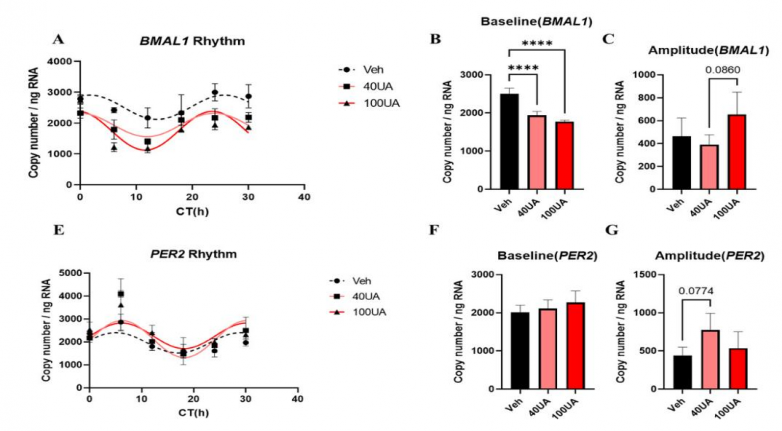
2.增强NAD内源合成能力,促进细胞能量代谢
研究表明,尿石素A可以显著提升细胞NAD+水平,促进细胞能量代谢,帮助提升日间精力。动物实验中,补充尿石素A后,小鼠体内的NAD+水平显著提升50%,且其提升效能相当于5倍剂量的NR17。
值得关注的是,尿石素A对NAD+的提升不同于外源性前体补充,而是通过激活SIRT1-NAMPT通路,从源头增强NAD+的内源性合成能力17。这种增强自然代谢的机制,为长期服用的安全性提供了理论支撑。
3.改善睡眠剥夺性疲劳,提升日间生理机能
在睡眠剥夺小鼠模型中,尿石素A展现出优于咖啡因的抗疲劳特性。补充尿石素A后,睡眠剥夺小鼠的握力相较于未补充组提升了35%(咖啡因组仅12%)。在评估小鼠的平衡能力和运动耐力的转棒实验(ROTA-ROD)中,补充尿石素A的小鼠感受到疲劳的时间大幅延长,改善幅度约为100%,同时还改善了睡眠剥夺小鼠的肠道菌群失调18。
4.睡出好皮肤,昼夜节律驱动的皮肤年轻通路
睡眠是皮肤的“天然美容剂”,其对皮肤的影响本质上是昼夜节律、激素平衡、屏障功能共同作用的结果。长期睡眠不足会从基因表达、细胞代谢到宏观结构层面加速皮肤衰老。对于现代人而言,将“睡出好皮肤”纳入健康管理,或许比任何昂贵护肤品都更具性价比。
夜间是皮肤自我修复的黄金时段,从机制上看,尿石素A可增强皮肤成纤维细胞BMAL1节律振幅,提升胶原蛋白合成相关基因(如COL1A1)的表达,从而促进受损屏障修复与弹性纤维再生。

三、尿石素A开启睡眠与抗衰实证临床研究
1.睡眠质量临床:解码衰老与睡眠的交互机制
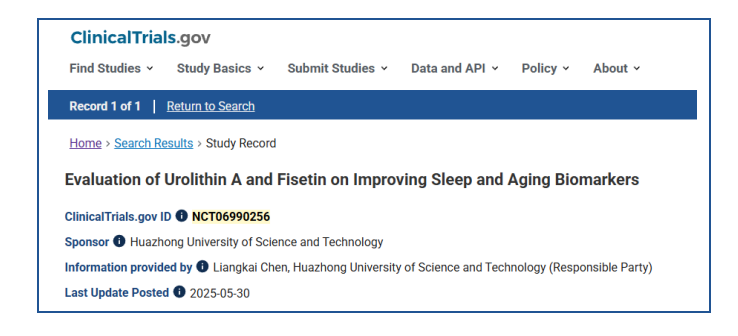
邦尚健康于2025年初启动的尿石素A睡眠质量干预临床研究(美国临床注册号#NCT06990256),旨在从衰老生物学视角探索睡眠障碍的解决路径。
该项随机对照研究预计纳入80名45-70岁受试者,采用四盲设计(受试者、医护人员、研究者、评估者均设盲),设置尿石素A单药组、非瑟酮单药组、联合用药组及淀粉安慰剂组,进行12周干预。首次系统性评估尿石素A对昼夜节律重整及衰老相关睡眠障碍的干预潜力。
2.临床核心研究设计:
入组标准:睡眠质量受损但未达病理诊断的亚临床人群(PSQI评分>5分),排除咖啡因 / 酒精依赖者,确保干预效果的纯粹性。
多维度评估:
主观指标:睡眠质量评分、昼夜类型问卷(晨型/夜型倾向)、日间功能障碍量表;
客观指标:体动记录仪连续监测、多导睡眠图分析;
生物标志物:NAD+ 水平、DNA甲基化年龄、炎症因子(血浆白细胞介素)、皮质醇水平、节律蛋白、胰岛素抵抗指数、免疫球蛋白水平等。
“我们不仅关注睡眠时长与碎片化程度,更希望通过表观遗传时钟、代谢稳态等指标,揭示睡眠障碍与衰老进程的因果关系。”项目负责人表示,“尿石素A与非瑟酮的联合用药设计,旨在探索 “昼夜节律调节+衰老细胞清除”的协同效应,这或将为更年期睡眠障碍等复杂场景提供新方案。”
四、邦尚健康的科学承诺:从“原料创新”到“健康生态”
作为高纯度尿石素A生产企业,邦尚健康的研发路径始终遵循 “原料科学-机制研究-临床转化”的全链条布局。邦尚健康正面向全球招募临床合作伙伴,欢迎学术界、产业界共同探索尿石素A在睡眠健康,细胞抗衰等更多领域的应用潜力。
当“抗衰老”从消费主义叙事转向科学理性,邦尚健康以尿石素A为支点,撬动的不仅是单一成分的市场价值,更是整个行业对“证据为本”的回归。从皮肤到睡眠,从分子机制到临床终点,未来的抗衰解决方案,必须是机制清晰、数据明确、场景精准的系统性方案。

参考文献:
1.LuisSan,BelénArranz.TheNightandDayChallengeofSleepDisordersandInsomnia:ANarrativeReview.ActasEsp Psiquiatr,2024Feb5;52(1):45-56.
2.Bhagavan.S.M.,&Sahota,P.K.(2021).SleepFragmentationandAtherosclerosis:isThereaRelationship?.Missourimedicine,118(3),272–276.
3.WangJunxiu,ZhangYan,LiYanze.ChinaSleepResearchReport[M].SocialSciencesAcademicPress,2025.
4.Feeney,S.P.,McCarthy,J.M.,Petruconis,C.R.,& Tudor,J.C.(2025). Sleep loss is a metabolic disorder.Science signaling, 18(881),eadp9358.
5.Carreras, A.,Zhang, S. X., Peris, E., Qiao, Z., Gileles-Hillel, A., Li, R. C., Wang, Y., & Gozal, D. (2014). Chronic sleep fragmentation induces endothelial dysfunction and structural vascular changes in mice. Sleep, 37(11), 1817–1824.
6. Bonmati-Carrion, M. A., Arguelles-Prieto, R., Martinez-Madrid, M. J., Reiter, R., Hardeland, R., Rol, M. A., & Madrid, J. A. (2014). Protecting the melatonin rhythm through circadian healthy light exposure. International journal of molecular sciences, 15(12), 23448–23500.
7.Boivin, D. B., Boudreau, P., & Kosmadopoulos, A. (2022). Disturbance of the Circadian System in Shift Work and Its Health Impact. Journal of biological rhythms, 37(1), 3–28.
8. Mosure, S. A., Wilson, A. N., & Solt, L. A. (2022). Targeting Nuclear Receptors for TH17-Mediated Inflammation: REV-ERBerations of Circadian Rhythm and Metabolism. Immunometabolism, 4(2), e220006.
9.Yang, Z., Zarbl, H., Kong, B., Taylor, R., Black, K., Kipen, H., Basaly, V., Fang, M., & Guo, G. L. (2024). Liver-gut axis signaling regulates circadian energy metabolism in shift workers. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 38(22), e70203.
10.Kravitz, H. M., Ganz, P. A., Bromberger, J., Powell, L. H., Sutton-Tyrrell, K., & Meyer, P. M. (2003). Sleep difficulty in women at midlife: a community survey of sleep and the menopausal transition. Menopause (New York, N.Y.), 10(1), 19–28.
11.Herbison A. E. (1997). Estrogen regulation of GABA transmission in rat preoptic area. Brain research bulletin, 44(4), 321–326.
12.Santoro, N., Epperson, C. N., & Mathews, S. B. (2015). Menopausal Symptoms and Their Management. Endocrinology and metabolism clinics of North America, 44(3), 497–515.
13.Walker, W. H., 2nd, Walton, J. C., DeVries, A. C., & Nelson, R. J. (2020). Circadian rhythm disruption and mental health. Translational psychiatry, 10(1), 28.
14.Pourhamzeh, M., Moravej, F. G., Arabi, M., Shahriari, E., Mehrabi, S., Ward, R., Ahadi, R., & Joghataei, M. T. (2022). The Roles of Serotonin in Neuropsychiatric Disorders. Cellular and molecular neurobiology, 42(6), 1671–1692.
15.Yao Du, Xinyue Chen et al. Effect of Urolithin A on the Improvement of Circadian Rhythm Dysregulation in Intestinal Barrier Induced by Inflammation. Nutrients 2024, 16, 2263.
16.Rassul Kuatov, Jiro Takano et al. Urolithin A Modulates PER2 Degradation via SIRT1 andEnhances the Amplitude of Circadian Clocks in HumanSenescent Cells. Nutrients 2025, 17, 20.】
17.Ghosh Nandini, et al. Urolithin A augments angiogenic pathways in skeletal muscle by bolstering NAD+ and SIRT1. Sci Rep. 2020 Nov 19;10(1):20184.
18.Hongkang Zhu, Haotian Zhao et al. Urolithin A Ameliorates Athletic Ability and Intestinal Microbiota in Sleep Deprivation from the Perspective of the Gut-Muscle Axi. Mol Nutr Food Res. 2024 Apr;68(7):e2300599.
特别声明:以上文章内容仅代表作者本人观点,不代表本网站观点或立场。如有关于作品内容、版权或其它问题请与我们联系删除或修改。

 澳鸟-全球资讯平台
澳鸟-全球资讯平台